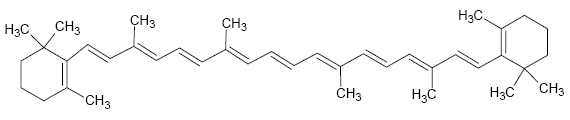
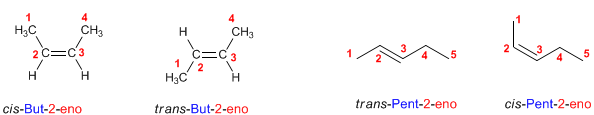LOS DIENOS
Los Dieno, son alquenos que contienen dos dobles enlaces carbono–carbono, por lo que tienen esencialmente las mismas propiedades que estos hidrocarburos.
Los dienos aislados no tienen propiedades de enlace diferentes de los alquenos. Los dienos acumulados y conjugados sí tienen propiedades especiales.
Propiedades físicas
Dienos acumulados (alenos)
El carbono central de los dienos acumulados (alenos) se encuentra en hibridación sp.
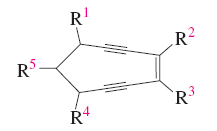
Los alenos pueden ser quirales: Aunque los alenos no poseen ningún estereocentro, los que tienen dos sutituyentes distintos en los extremos tienen un eje quiral que ocasiona que objeto e imagen no sean superponibles. Por tanto el 2,3-pentadieno tiene dos estructuras enantioméricas.
Para determinar la configuración de un aleno se numeran los sustituyentes, primero los del carbono de delante y despues los de detrás, siguiendo las reglas de prelación habituales. Se dibuja un tetraedro tal y como se muestra en la figura, se sitúa el sustituyente de menor prelación hacia atrás y se observa el sentido de giro necesario para ir de 1 á 2 y á 3.
2-. Dienos conjugados
El enlace central de los dienos conjugados tienen un carácter doble parcial. La longitud del enlace central es intermedia entre la de uno simple y uno doble.
El solapamiento lateral de los cuatro orbitales atómicos p produce cuatro orbitales moleculares.
El orbital p1 deslocaliza la densidad electrónica a lo largo de los cuatro átomos implicados en un dieno conjugado.
Esto explica el carácter doble parcial del enlace central.La pequeña contribución de las formas resonantes con separación de cargas también explican que el enlace central tenga un pequeño carácter doble.
- Ejemplo de propiedades físicas de dienos.
El 1,3 – butadieno o divinilo es un gas fácilmente licuable (a – 5°C).
El – 2 – metil – 1,3 – butadieno, o isopreno es un líquido de fácil ebullición.
Propiedades químicas
Los hidrocarburos diénicos, disponiendo de dobles enlaces en las moléculas, causan reacciones de adición corrientes, por ejemplo, decoloran el agua de
bromo, adicionan los a haluros de hidrógeno, etc. Sin embargo, las reacciones de adición tienen sus peculiaridades. Los dienos conjugados difieren de los alquenos simples en tres aspectos:
1.Son más estables.
2.Sufren adición 1,4.
3.Son más reactivos en la adición de radicales libres.
1. Combustión
C4H8 + O2 →4CO2 + 4H2O
2. Hidrogenación CH2=CH-CH=CH2 + 2H2 = CH3-CH2-CH2-CH3 2.1 Dienos aislados:
Los dobles enlaces reaccionan independientemente, como si estuvieran en moléculas diferentes.
Obtención
1.Por deshidrogenación del alcanos.
2.Mediante el cracking de hidrocarburos.
3.Por el proceso de deshidratación y desdidrogenación de alcohol etílico.
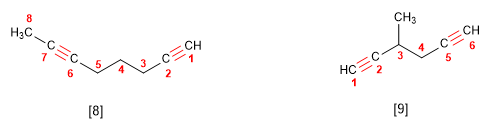
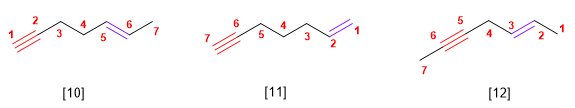
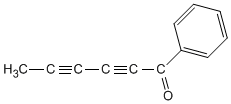 El acetileno fue usado en la industria para preparar acetaldehído, acido acético, cloruro de vinilo y polímeros acrílicos.
El acetileno fue usado en la industria para preparar acetaldehído, acido acético, cloruro de vinilo y polímeros acrílicos.