ESTEQUIOMETRIA
MOLES:
Para hallar el numero de moles presentes en una muestra, se divide el valor en gramos de la muestra por el valor de una mol de dicha muestra.
ejemplo
* cuantos moles hay en 160 gramos de SO3
1 mol de SO3 x mol de SO3
--------------------- = ------------------------
80 grs. de Na 160 grs de SO3
1 mol de SO3 x 160 grs. de SO3
--------------------------------------------- = 2 mol de SO3
80 grs. de SO3
jueves, 19 de febrero de 2015
domingo, 15 de febrero de 2015
EL CARBONO
Carbono, de símbolo C, es un elemento crucial para la existencia de los organismos vivos, y que tiene muchas aplicaciones industriales importantes. Su número atómico es 6; y pertenece al grupo 14 (o IV A) del sistema periódico.
Propiedades
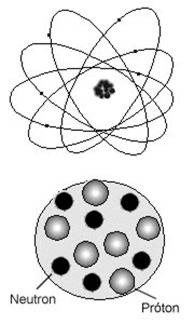 |
| Átomo de carbono. |
Las propiedades físicas y químicas del carbono dependen de la estructura cristalina del elemento.
Un gran número de metales se combinan con el elemento a temperaturas elevadas para formar carburos.
Con el oxígeno forma tres compuestos gaseosos: monóxido de carbono, CO, dióxido de carbono, CO2, y subóxido de carbono, C3O2.
Los dos primeros son los más importantes desde el punto de vista industrial.
El carbono es un elemento único en la química porque forma un número de compuestos mayor que la suma total de todos los otros elementos combinados.
El grupo más grande de estos compuestos es el constituido por carbono e hidrógeno. Se estima que se conoce un mínimo de 1.000.000 de compuestos orgánicos y este número crece rápidamente cada año. Aunque la clasificación no es rigurosa, el carbono forma otra serie de compuestos considerados como inorgánicos, en un número mucho menor al de los orgánicos.
Las tres formas de carbono elemental existentes en la naturaleza (diamante, grafito y carbono amorfo) son sólidos con puntos de fusión extremadamente altos, e insolubles en todos los disolventes a temperaturas ordinarias. Las propiedades físicas de las tres formas difieren considerablemente a causa de las diferencias en su estructura cristalina.
En el diamante, el material más duro que se conoce, cada átomo está unido a otros cuatro en una estructura tridimensional, mientras que el grafito consiste en láminas débilmente unidas de átomos dispuestos en hexágonos.
El carbono químicamente puro se prepara por descomposición térmica del azúcar (sacarosa) en ausencia de aire.
El carbono tiene la capacidad única de enlazarse con otros átomos de carbono para formar compuestos en cadena y cíclicos muy complejos. Esta propiedad conduce a un número casi infinito de compuestos de carbono, siendo los más comunes los que contienen carbono e hidrógeno.
Suscribirse a:
Entradas (Atom)